[El médico, químico y geólogo inglés John Kidd (1775 - 1851) fue el descubridor del naftaleno o naftalina. Fue él quien le dio el nombre a este compuesto orgánico y describió sus propiedades en 1821. Cinco años después el gran Michael Faraday, padre del electromagnetismo, determinó su fórmula química (C10H8). Pero no lo sabemos todo de un compuesto orgánico hasta que no queda perfectamente definida su estructura. Fue Emil Erlenmeyer (¿les suena el nombre?) quien propuso en 1866 una estructura consistente en dos anillos de benceno fusionados; lo cual fue confirmado tres años después por Carl Gräbe. El naftaleno es el hidrocarburo aromático policíclico más sencillo.
Procedencia de la imagen aquí]
El naftaleno o naftalina es un sólido blanco (también es conocido como alquitrán blanco) de fórmula C10H8 y estructura de doble anillo de benceno. Se obtiene de forma natural al quemar combustibles (por ejemplo, al quemar madera o tabaco). Es un compuesto volátil de fuerte y fácilmente reconocible olor. Nos es bastante familiar por haber sido usado como antipolillas (repelente) en nuestros roperos y hogares. Pero hay que tomar precauciones porque este hidrocarburo aromático puede intoxicarnos y dañar a los glóbulos rojos, los transportadores de oxígeno en nuestra sangre (pínchese aquí para saber más).
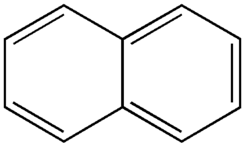
El naftaleno es el componente principal del alquitrán de hulla. Actualmente se usa en la fabricación de plásticos y en síntesis de compuestos orgánicos (ftálicos y otros) con distintas aplicaciones. Aquí les presento su estructura, dos anillos aromáticos de benceno fusionados:
[Procedencia de las imágenes: Wikipedia]
Su punto de fusión es de 80 ºC y resulta fácil e interesante (con fines didácticos) su determinación experimental en el laboratorio (pínchese aquí). Anotando en una tabla las temperaturas del naftaleno a diferentes tiempos podemos construir las gráficas de calentamiento y de enfriamiento de esta sustancia sólida a temperatura ambiente. Observaremos cómo la temperatura de fusión y la de solidificación coinciden y cómo mientras una sustancia pura está cambiando de estado no varía su temperatura (en este caso, el punto de fusión característico del naftaleno, 80 ºC). Mientras una sustancia está cambiando de estado toda la energía que aportamos se emplea en producir dicha transformación física, venciéndose las fuerzas de atracción intermoleculares, separándose las moléculas, y no vuelve a ascender la temperatura hasta que se ha completado el cambio de estado (en nuestro caso cuando todo el naftaleno se ha fundido y convertido en líquido).
[Fusión del naftaleno calentando al baño de María. Imagen procedente de Wikimedia]
Dejo este interesante y bien realizado vídeo del Laboratorio de Química de la E.U.I.T. Aeronáuticos (Universidad Politécnica de Madrid). Que sea de provecho:


10 comentarios:
Muy bien explicado.
Me sirvio mucho para realizar mi experimento de fisica.
Como son las fuerzas intermoleculares altas bajas como son?
Muchísimas gracias didáctica explicación. Lamento hacer conocer que sólo la vanidad unida a la totalirresponsabilidad puede llevar a una persona a pulverizarlo y con vaselina mezclarlo para untarse en el abdomen en procura para "bajar de peso"
Porqué se calienta a baño de maria y no directamente ala llama?
Me explican como resolverlo xd
Q locura q materia vrg química
Todo una mierda
Naftaleno por lo paso por los huevos
Publicar un comentario