[Característica llama verde del talio (Tl). Procedencia de la imagen aquí]
Entre los elementos químicos más tóxicos (cadmio, mercurio, plomo, arsénico, antimonio...) ocupa un lugar destacado el metal de número atómico 81, el temido talio (Tl), elemento del bloque p de la Tabla Periódica situado en el grupo 13, sexto periodo. Tiene por tanto 3 electrones en su capa de valencia o última capa, que es la sexta, siendo su configuración de valencia 6s26p1. Comparte familia (grupo) con el boro (B), un semimetal, el ligero aluminio (Al). el galio (Ga, que funde en nuestra mano, pues su punto de fusión es de unos 30 ºC) y con el metal que da una característica línea de color índigo en el espectro de emisión, el indio (In).
El tóxico talio es un metal muy blando, bastante denso (11,85 g/cm3 o 11850 kg/m3), que funde a una temperatura relativamente baja (304 ºC). siendo líquido en un intervalo muy amplio, pues no hierve hasta los 1473 ºC (su punto de ebullición). Presenta el característico número de oxidación +3 del grupo y también el +1 (lo cual, adelantamos ya, tiene su importancia desde el punto de vista toxicológico). Ocupa la posición número 60 en abundancia, con 0,85 mg/kg en la corteza terrestre, es decir, una abundancia del 0,000085 %. Se encuentra en algunos minerales de selenio y en muchos sulfuros como piritas (FeS2) y blenda de cinc (ZnS). Dada la elevada toxicidad se usa muy poco este metal. Así el talio (su sulfato) ha sido empleado como raticida y para exterminar hormigas y otras plagas. Las sales de talio fueron usadas en medicina, particularmente en el tratamiento de infecciones de la piel y la tiña (causada por hongos parásitos de la queratina, afectando a uñas y pelos). Su uso como medicamento ha sido muy limitado debido al estrecho margen de seguridad para la dosis. A pesar de ello, la temeridad humana, o la ignorancia, no tienen límites y en los años treinta del siglo XX fue usado como depilatorio. Sales de talio tienen aplicaciones interesantes en óptica y electrónica en relación con la radiación infrarroja (así, el bromuro y el yoduro de talio forman cristales duros que transmiten longitudes de onda más largas que otros).
Pero veamos algo de la interesante, y controvertida, historia del descubrimiento del talio. Para ello nos remontamos hasta mediados del siglo XIX, una época trascendental para el descubrimiento de nuevos elementos ocultos en los minerales. Es la época en la que, gracias a Kirchhoff y Bunsen, la espectroscopía permite seguir avanzando en la ardua tarea de completar la relación de sustancias elementales.
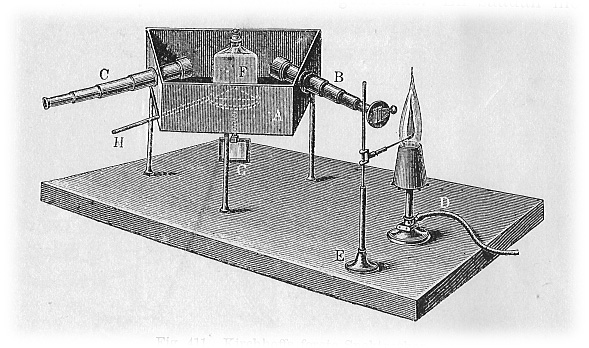
[Espectroscopio de KIRCHHOFF. Se observa, entre otros componentes, el mechero Bunsen (D), el prisma (F) para descomponer la luz emitida y obtener un espectro atómico con distintas líneas características de ciertos colores y el telescopio (C)]
En 1859 Bunsen y Kirchhoff inventan el espectroscopio y muy poco tiempo después anuncian el descubrimiento de dos nuevos elementos con su aparato: el cesio en 1860 (Cs, metal alcalino llamado así por su "bella raya espectral azul", del latín caesius, "azul verdoso") y el rubidio en 1861 (Rb, otro metal del grupo 1 llamado así porque, como cuentan en su informe, "el magnífico color rojo oscuro de estas rayas del nuevo metal alcalino nos indujo a dar a este elemento el nombre de rubidio, y el símbolo Rb, derivado de rubidus, que, entre los antiguos, sirvió para designar el rojo más intenso").
Y solo un mes más tarde, a finales de marzo de 1861, William Crookes anuncia el hallazgo de otro elemento más, el talio, empleando la técnica espectroscópica de Bunsen y Kirchhoff. Siguiendo el mismo criterio que ellos, Crookes da nombre al nuevo metal (talio, Tl) por su llamativo espectro, en el que observa una línea verde, pues thallos en griego significa "rama verde".
William Crookes (1832 - 1919), primero en observar una raya espectral verde correspondiente a un elemento no conocido (talio), ingresó muy joven (con tan solo dieciséis años) en el Royal College of Chemistry de Londres, donde era profesor nada más y nada menos que el prestigioso químico alemán August W. von Hofmann (fundador de la industria de los colorantes de anilina, siendo el primero en preparar nitrobenceno y la mencionada anilina o aminobenceno a partir del benceno).
[El químico inglés William Crookes en 1906. descubridor del elemento metálico talio]
A pesar de haber trabajado con Hofmann, el bueno de Crookes nunca se sintió atraído por la investigación en química orgánica (la cual se desarrolló enormemente a lo largo del siglo XIX). Su primer trabajo científico fue sobre los selenocianuros. Precisamente Hofmann le había suministrado unos residuos de la fábrica de ácido sulfúrico de Tilkerode (en el Harz, Alemania) para que utilizara los compuestos de selenio en la preparación de selenocianuros. Crookes, una vez que obtuvo el selenio de dichas muestras, guardó los mencionados residuos minerales porque pensaba que también contendrían teluro. Y hete aquí que el químico inglés somete los residuos de Tilkerode a la técnica de espectroscopía, encontrando, no alguna señal de la presencia de teluro, sino una preciosa e inesperada raya verde que debía de corresponder a un nuevo elemento. Como ya hemos dicho, William Crookes lo llamó talio por la línea verde de su espectro atómico de emisión, que debió de recordar al químico londinense a la rama verde de una planta. Lo que no sabía era que había descubierto un metal extremadamente tóxico.
Digamos que Crookes puso su interés más que en la investigación química en el estudio de fenómenos propios de la física. Inventó en 1873 el radiómetro o molinillo de luz. En 1875 inventó un tubo de vacío (que lleva su nombre), indicando que la radiación del cátodo (electrodo negativo), los rayos catódicos, se movían en línea recta y demostró que dichos rayos catódicos eran desviados por un imán, pensando en que en realidad eran partículas cargadas desplazándose en línea recta (en ausencia de imán) en lugar de radiación electromagnética (Crookes pensó en este haz de partículas cargadas como constituyentes de una especie de cuarto estado de la materia, una suerte de gas con un grado muy elevado de enrarecimiento). Años más tarde se descubriría que dichos rayos catódicos eran, efectivamente, partículas negativas procedentes del cátodo, los electrones. Como anécdota curiosa, bien conocida, señalemos que el bueno de Crookes fue seguidor (como tantos otros en la época, algunos importantes científicos) del espiritismo y se interesó por los fenómenos psíquicos, investigándolos de forma honesta, pero fue víctima de diversos engaños.
[Tubo de Crookes. C es el electrodo negativo o cátodo y P es el ánodo o electrodo positivo revestido de fósforo. Procedencia de la imagen aquí]
Dijimos al principio que la historia del descubrimiento del talio tiene su controversia, respecto a la autoría. Una disputa como esta no es nada rara en ciencia y tampoco en el descubrimiento de nuevos elementos, cuya paternidad genera a veces polémica (sin ir más lejos pensemos en el vanadio). Es aquí cuando entra en escena el químico francés Claude Auguste Lamy (1820 - 1878), primero en obtener un lingote de talio metálico. Pero de esto y de la toxicidad del talio hablaremos en otra ocasión. Y es que del venenoso talio, el elemento criminal, no se puede hablar a la ligera...
(CONTINUARÁ)
De interés en Internet:
- TOXICOLOGÍA DEL TALIO: http://aspiringtoxicologist.blogspot.com/2013/12/thallium.html
- LA DOSIS Y EL VENENO: http://devenirdelaciencia.blogspot.com/2009/02/la-dosis-y-el-veneno.html
- LOS NIÑOS DEL TALIO (el terrible caso del Hospicio Provincial de Granada en 1930):